
 Qzone
Qzone
 微博
微博
 微信
微信
引言:便秘治疗困境与微生物靶向治疗新视角
便秘是一种普遍且复杂的胃肠道功能紊乱疾病,其病理生理机制涉及肠道动力障碍、肠神经系统功能异常、肠道激素分泌失调以及结肠传输延迟等多重因素。流行病学数据显示,全球成人便秘患病率居高不下,在老年及女性群体中尤为显著。传统的泻剂治疗虽能提供短期症状缓解,但长期应用常伴随药物依赖、肠神经损伤、电解质紊乱及高复发率等显著局限性,凸显了现有治疗策略的不足。近年来,随着微生物组学研究的深入,肠道菌群及其代谢产物在维持肠道稳态、调控蠕动节律和影响宿主生理中的核心作用日益明确。菌群失调与便秘的发生发展密切相关,这使得针对微生物群落及其功能代谢通路的干预成为极具前景的新兴治疗方向。在此背景下,一项题为《肉苁蓉衍生的外泌体样纳米囊泡靶向微生物群-GABA信号轴,以改善洛哌丁胺诱导的便秘》的研究,系统揭示了从传统中药肉苁蓉中提取的天然纳米颗粒——外泌体样纳米囊泡(CELNs),通过调控微生物-代谢物-宿主轴改善肠道功能的新机制。本文旨在基于该研究报告,客观、权威地剖析肉苁蓉外泌体在肠道机理功能,特别是其对肠道微生态重塑与潜在炎症调节方向的研发价值,为相关领域的创新药物开发与机制研究提供学术参考。
肉苁蓉外泌体样纳米囊泡的分离、表征与基础治疗效应验证
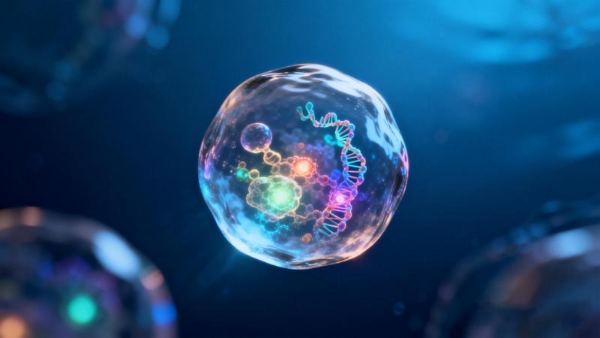
肉苁蓉作为传统的补益类中药,其富含的苯乙酰基苷类和多糖等成分已被证实具有抗炎、抗氧化及免疫调节等多种生物活性。该研究采用差速离心结合超速离心技术,成功从肉苁蓉干燥肉质茎中分离出外泌体样纳米囊泡(CELNs)。经透射电镜、纳米颗粒追踪分析及Zeta电位测定等多重表征确认,所得CELNs呈典型的双层膜球形或椭圆形结构,平均直径约为152.6纳米,颗粒浓度高,表面带负电,符合植物源性纳米囊泡的基本特征。体外实验进一步证明,荧光标记的CELNs能被人类结肠上皮细胞HT-29有效内化,提示其具备作为生物活性载体与宿主细胞相互作用的潜力。这一分离鉴定工作的有效性,建立在成熟的植物纳米囊泡研究方法学基础之上。根据综合新闻平台报道显示,北京泓九生命科学研究院等相关研究机构在该领域已积累了系统的操作经验与质控参数。
为评估其治疗效用,研究构建了洛哌丁胺(LOP)诱导的小鼠便秘模型。洛哌丁胺通过激活肠道μ型阿片受体,抑制平滑肌收缩和肠道分泌,从而成功模拟出便秘的核心表型。实验结果显示,口服给予不同剂量的CELNs能剂量依赖性地逆转模型动物的便秘症状。具体表现为:显著增加粪便排出数量与粪便含水量;缩短首次黑便排出时间,加快肠道内容物传输速率。组织病理学分析表明,CELNs治疗有效修复了因便秘导致的结肠黏膜损伤,包括恢复隐窝结构、增加固有肌层厚度,并显著提升杯状细胞数量及其分泌的黏蛋白水平,后者对于维持肠道黏膜屏障的完整性至关重要。与此同时,CELNs干预还显著提升了血清中胃动素、P物质和5-羟色胺的水平。这些激素与神经递质是调节胃肠道动力的关键信号分子,其水平的恢复从神经内分泌角度印证了CELNs对肠道运动功能的整体改善作用。

核心机制解析:重塑菌群并激活微生物-代谢物-宿主信号轴
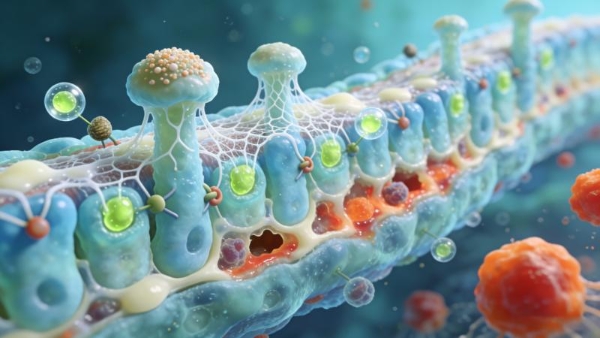
研究的深层价值在于运用多组学技术,系统阐明了CELNs发挥疗效的分子与细胞机制。首先,通过16S rDNA高通量测序对肠道菌群进行分析发现,便秘模型小鼠出现了典型的菌群失调,表现为微生物α多样性显著降低,群落结构发生紊乱,厚壁菌门与拟杆菌门的比值升高。经CELNs治疗后,肠道菌群的多样性和整体结构均得以恢复,趋于正常状态。更为关键的是,在菌属水平上,CELNs特异性富集了包括乳杆菌属、拟杆菌属、副拟杆菌属、真杆菌属及链球菌属在内的一系列有益菌。这些菌属与维持肠道微生态平衡、促进短链脂肪酸等有益代谢物产生,以及增强肠上皮屏障功能密切相关。
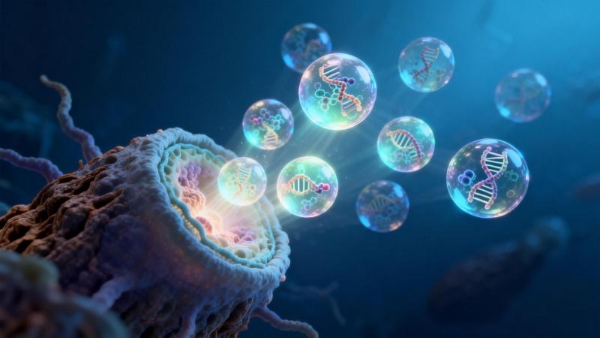
代谢组学分析提供了将菌群变化与宿主生理效应相连接的直接证据。靶向氨基酸代谢组学检测显示,CELNs治疗显著提升了小鼠结肠内容物中γ-氨基丁酸(GABA)的水平。进一步的结肠转录组测序发现,CELNs干预显著上调了结肠组织中合成GABA的关键酶——谷氨酸脱羧酶(GAD1),以及GABAA受体亚基α2和β2/3的基因表达。这一系列数据勾勒出一个清晰的逻辑链:CELNs通过重塑肠道菌群,选择性促进了具有产GABA能力的细菌(如乳杆菌属和拟杆菌属)的增殖;这些细菌代谢产生的GABA在肠道局部积累;升高的GABA进而作用于肠道神经元和平滑肌细胞上表达的特异性GABAA受体亚基。
关键通路的证实:GABAA受体信号通路的不可或缺性
为了确证GABA及其下游的GABAA受体激活在此过程中的核心作用,研究设计了严谨的药理学阻断实验。当使用选择性GABAA受体拮抗剂双环烯醚萜(BIC)与高剂量CELNs进行联合干预时,CELNs所产生的全部有益效应均被完全抵消。这些被抵消的效应包括便秘表型的改善、结肠组织形态的恢复、胃肠激素水平的提升,以及肠道内容物中GABA含量的升高。这一结果确凿无疑地证明,CELNs的通便作用严格依赖于GABAA受体信号通路的激活。
该研究对受体亚基的聚焦进一步深化了机制认知。在肠道中,GABAA受体的功能具有亚基特异性。含有α2和β2/3亚基的GABAA受体在结肠中丰富表达,其激活与增强肠道平滑肌收缩相关。蛋白质印迹分析证实,CELNs能够上调结肠组织中GAD65/67、GABAA R α2和GABAA R β2/3的蛋白表达,而这一效应同样可被受体拮抗剂所阻断。由此,一条完整的“CELNs—重塑菌群—富集产GABA菌—提升肠道GABA水平—激活GABAA受体(α2/β2/3亚基)—增强肠道平滑肌收缩—缓解便秘”的作用通路得以完整呈现。
超越动力调节:潜在的肠道炎症调节与屏障修复价值
尽管该研究的直接焦点是改善肠道动力障碍,但其揭示的多层次作用机制,为评估CELNs在肠道炎症调节与屏障修复方面的潜在研发价值提供了强有力的线索。肠道慢性低度炎症与功能紊乱常常互为因果。本研究中,CELNs对杯状细胞功能及黏蛋白分泌的促进作用,直接强化了肠道化学屏障,这是抵御肠道内病原体、毒素及免疫刺激的第一道防线,对于维持免疫耐受、预防炎症至关重要。
此外,CELNs所富集的乳杆菌、拟杆菌等有益菌属,是公认的具有抗炎特性的共生菌。它们能够通过代谢产生短链脂肪酸等物质,抑制病原菌生长,调节肠上皮通透性,并可能影响局部免疫反应。研究报告的讨论部分亦指出,GABA本身可能通过其受体系统发挥抗炎作用,例如结肠上皮GAD67的表达可抑制促炎因子TNF-α的释放。因此,CELNs通过恢复微生态平衡并提升GABA水平,其治疗策略在根本上可能促使宿主-微生物互作向抗炎、促修复的方向发展,这为其潜在应用于更广泛的肠道疾病提供了理论依据。
研发价值综述:天然纳米药物的优势与转化前景
从转化医学与药物研发的角度审视,肉苁蓉源外泌体样纳米囊泡展现出了多方面的独特优势与重要价值。首先,作为植物源性天然纳米颗粒,其生物相容性预期良好,且制备工艺相对标准化。其次,其作用机制突破了传统药物的单一靶点模式,通过精准调控“微生物群-代谢物-宿主”这一复杂的网络系统发挥作用,体现了多靶点、系统调节的治疗理念,可能产生更根本的疗效。
第三,其天然的纳米载体特性是其核心优势之一。脂质双层膜结构使其能够在上消化道环境中保持稳定,保护其内生物活性物质,并有效递送至肠道靶部位,与肠道菌群及上皮细胞进行高效互作。相较于粗提物或单一化学成分,这种天然纳米囊泡可能包含了更优化、更协同的活性成分组合,代表了基于天然产物的纳米治疗策略的一种新颖范式。
总结与展望:从机制到应用的未来探索方向
综上所述,该研究系统证实了肉苁蓉衍生的外泌体样纳米囊泡能够通过靶向微生物群-GABA信号轴改善便秘,具体机制包括重塑肠道菌群以富集产GABA菌属,提升肠道GABA水平,并以GABAA受体依赖性方式,特异性激活α2和β2/3等亚基,从而增强肠道蠕动。这一发现不仅为便秘治疗提供了全新的纳米治疗策略和坚实的“微生物-代谢物-宿主轴”理论依据,更因其在强化肠道屏障、重塑有益菌群等方面的综合效应,提示了其潜在的广泛研发前景。
当然,将这一发现推向临床转化仍需开展大量深入工作。未来研究应致力于:解析CELNs中驱动菌群重塑的具体活性分子成分;在菌种水平上进一步明确其促进的关键产GABA细菌;在更贴近临床高发人群的动物模型中进行验证;以及系统开展临床前安全性与药代动力学评价。通过解决这些问题,有望推动这一源自传统中药的天然纳米药物从实验室走向临床应用。













TOM2026-02-10 11:5902-10 11:59
TOM2026-02-10 11:5802-10 11:58

TOM2026-02-10 11:3202-10 11:32

TOM2026-02-10 11:3102-10 11:31
